

中药小分子黄芪甲苷Ⅳ(Ast)具有抗衰老等多种生物学功能,其对年龄相关性黄斑变性(AMD)病理过程中的视网膜色素上皮(RPE)细胞衰老具有潜在保护作用,但Ast在AMD进展中的具体作用尚不清楚。
m6A甲基化是一种由甲基化酶、去甲基化酶和甲基化阅读蛋白共同调控的可逆RNA甲基化修饰,m6A甲基化是目前潜在治疗靶点发现等研究的热点之一,其动态变化与多种生物学过程密切相关,如细胞分化和疾病发生等。其中,FTO蛋白作为一种m6A去甲基化酶,能够去除RNA分子上的m6A修饰调控基因的表达。
该研究首次揭示了黄芪甲苷IV(Ast)抑制RPE细胞衰老的作用,利用DARTS技术发现了Ast的作用靶点是m6A去甲基化酶FTO,二者结合能够促进m6A甲基化修饰,从而影响IL-1β mRNA稳定性,使其表达下调,最终抑制RPE细胞衰老,发挥治疗AMD的作用。本研究为AMD的临床治疗提供了极具研究价值的新靶点和新策略,同时突破了天然产物靶点挖掘和机制探索的现有研究范式,开拓了新的思路和方向。
01黄芪甲苷IV抑制RPE细胞衰老,减缓AMD进展
首先,研究人员通过体外实验确认了AST能够显著抑制NaIO3诱导的ARPE-19(人视网膜色素上皮细胞)衰老(图1A-B)。由于在AMD的发病机制中,RPE细胞衰老具有关键作用,研究人员进一步利用AMD小鼠模型探究Ast在体内的治疗潜力,发现Ast能够有效缓解AMD小鼠的相关症状(图1C-D)。以上结果表明,Ast能够通过抑制RPE细胞衰老,减缓AMD进展。
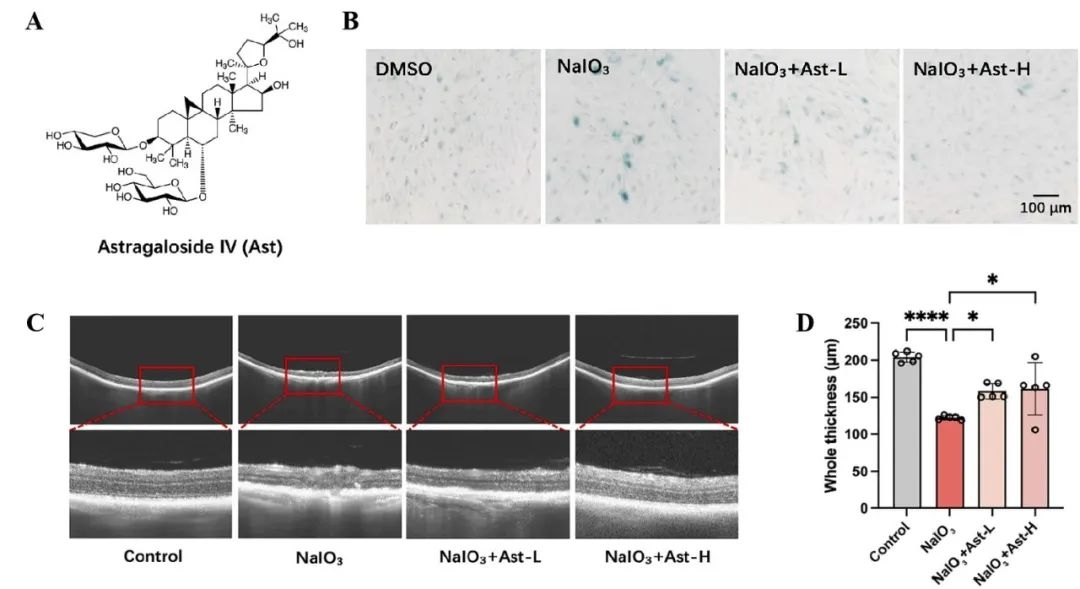
图1 黄芪甲苷IV抑制RPE细胞衰老,减缓AMD进展
02黄芪甲苷IV下调促炎因子IL-1β表达,抑制RPE细胞衰老
为了阐明Ast的作用机制,研究人员利用RNA-seq分析了Ast处理ARPE-19细胞后的差异表达基因(DEGs),KEGG结果显示,这些DEGs显著富集于炎症相关信号通路,如细胞因子-受体互作和肿瘤坏死因子(TNF)等(图2A)。值得注意的是,Ast显著下调了炎症基因如IL-1β,IL-6和Toll样受体2(TLR2)的表达(图2B)。随后,研究人员在体内及体外进行了RT-qPCR分析,结果证实了Ast能够显著下调IL-1β mRNA的表达(图2C-D)。以上研究结果提示,Ast可能通过抑制促炎因子的表达,减缓RPE细胞衰老,从而抑制AMD进展。
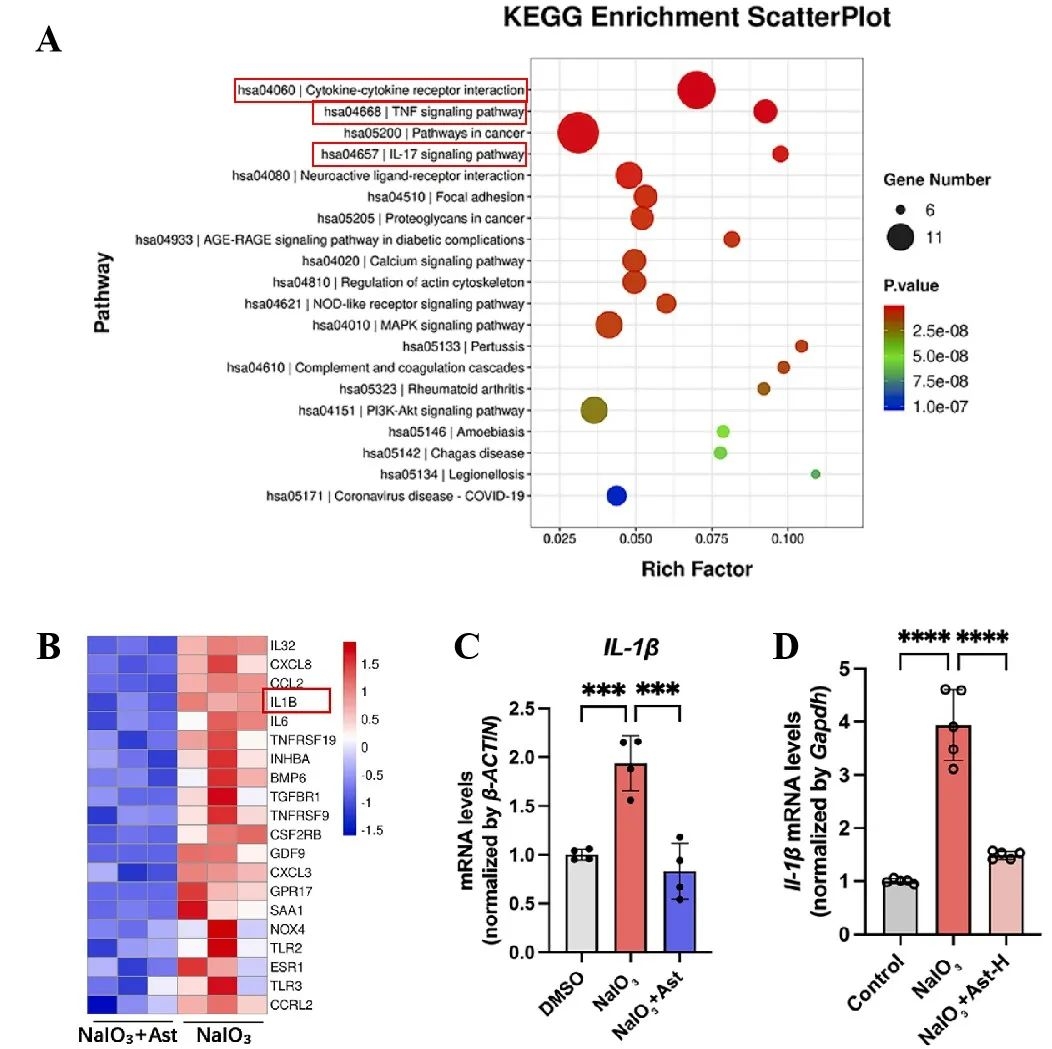
图2 黄芪甲苷IV下调促炎因子IL-1β表达,抑制RPE细胞衰老
03黄芪甲苷IV上调m6A甲基化,降低IL-1β mRNA稳定性
基于以上实验结果,研究人员继续探究Ast抑制IL-1β表达的内在机制,采用放线菌素D处理法检测Ast对IL-1β的mRNA稳定性的影响,结果显示,Ast显著降低了IL-1β的mRNA稳定性(图3A)。m6A 甲基化是一种影响mRNA稳定性的关键修饰方式,所以研究人员进一步探究了Ast对m6A甲基化的影响。MeRIP-qPCR结果显示,Ast显著上调了NaIO3处理后ARPE-19细胞的m6A水平和IL-1β的m6A修饰(图3B-C),这表明Ast通过促进IL-1β的m6A甲基化修饰,降低其mRNA的稳定性,从而下调IL-1β表达。
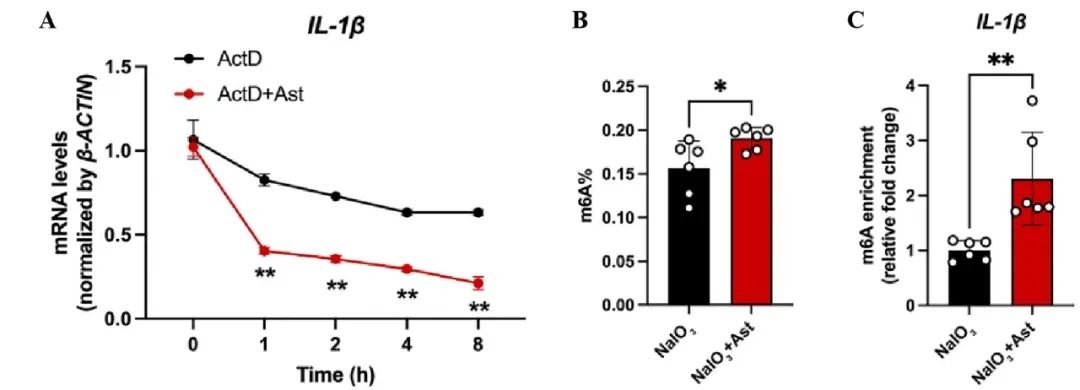
图3 黄芪甲苷IV上调m6A甲基化,降低IL-1β mRNA稳定性
04 FTO是黄芪甲苷IV调控m6A甲基化的作用靶点
接下来,研究人员继续探索Ast如何调控m6A修饰。利用DARTS技术发现Ast的作用靶点可能是m6A去甲基化酶FTO(图4A),分子对接和CETSA+WB等实验再次证实了二者间的相互作用(图4B-C)。结合上述实验结果,表明Ast直接靶向FTO,二者结合增强了m6A甲基化修饰,从而降低IL-1β mRNA的稳定性。最后,功能性实验结果证实了Ast依赖于FTO发挥治疗作用(图4D)。此外,进一步的体内实验表明抑制FTO能够有效减缓模型小鼠的AMD进展(图4E),证明FTO有望成为治疗AMD的新靶点。

图4 FTO是黄芪甲苷IV调控m6A甲基化的作用靶点
总结与讨论
本研究首次揭示了黄芪甲苷IV通过抑制RPE细胞衰老,减缓AMD进展的新机制,利用DARTS技术发现了Ast的靶点蛋白FTO,二者结合能够促进m6A甲基化修饰,从而影响IL-1β mRNA稳定性,使其表达下调,最终抑制RPE细胞衰老,发挥治疗AMD的作用。本研究为黄芪甲苷IV应用于AMD的临床治疗提供了数据支持,同时为天然产物的靶点研究拓展了新的视角。
文章来源:Wang SW, Li P, Liu SY, Huang DL, Zhang SJ, Zeng XX, Lan T, Mao KL, Gao Y, Cheng YF, Shen Q, Ruan YP, Mao ZJ. Astragaloside IV inhibits retinal pigment epithelial cell senescence and reduces IL-1β mRNA stability by targeting FTO-mediated m6A methylation. Phytomedicine. 2025 Mar;138:156408. doi: 10.1016/j.phymed.2025.156408. Epub 2025 Jan 18. PMID: 39848020.
免责声明:本文转自第三方平台,版权归原作者所有,仅供信息传播与参考,不代表本平台的观点和立场。如有异议请及时联系我们删除处理,联系邮箱lighter@medical-lighter.com
 0
0












